Nel XVIII secolo la rapida crescita del numero di composti conosciuti rese necessario un sistema di nomenclatura chimica standardizzato, che portò, nel 1787, alla pubblicazione del “Méthode de nomenclature chimique” , redatto da Antoine Lavoisier e altri chimici francesi.
La nomenclatura tradizionale, che si è cominciato così a normare, si basa sul nome storico dei composti, su natura e comportamento delle molecole e su valenza e numero di ossidazione degli elementi che ne fanno parte e i suffissi e i prefissi usati per descrivere le molecole, come -ico -oso -ato -ito -uro, usati ancora oggi, furono introdotti già in tale occasione.
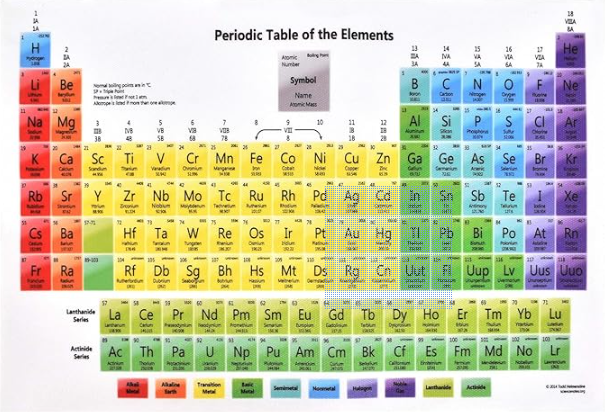
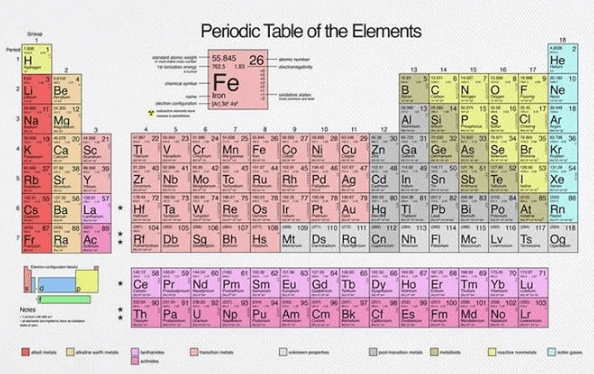
Per capire come funziona la nomenclatura inorganica tradizionale è necessario basarsi dalle informazioni disponibili sulla tavola periodica e su alcune regole basilari.
La valenza di un elemento chimico è il numero di legami chimici che un atomo di quell’elemento può formare per raggiungere una configurazione elettronica stabile (in genere quella del gas nobile più vicino), secondo la regola dell’ottetto. Essa è strettamente legata al gruppo (cioè la colonna) a cui appartiene l’elemento.
Nel legarsi, gli atomi seguono per lo più la regola dell’ottetto, cioè devono raggiungere otto elettroni nel guscio di valenza, cioè la configurazione del gas nobile che si trova nell’ultima colonna di destra.
Ciò fa sì che se un elemento ha più elettroni nel livello più esterno ha la tendenza ad acquistarne altri e se ha meno elettroni nel livello più esterno ha la tendenza a darli via. (Trovo utile il paragone con due mamme amiche tra di loro che cercano lavoro: nel caso in cui una di loro debba decidere di lavorare fuori casa e l’altra di rimanere in casa e guardare anche i figli dell’altra, se una di loro ha 1 figlio e una ne ha 7, in genere sarà la mamma con il figlio unico che lo affiderà a quella che ne ha 7 e non viceversa).
L’elettronegatività è la capacità, posseduta da un atomo che fa parte di una molecola, di attrarre gli elettroni dei legami covalenti in cui è coinvolto. In genere è essa cresce passando dalla parte sinistra alla parte destra della tavola periodica e andando dal basso all’alto.
La tavola periodica indica, attraverso la posizione, la natura degli elementi (metalli o non metalli) e quindi la loro elettronegatività: a separare i metalli dai non metalli è una scala che scende da sinistra a destra e il motivo è che più andiamo in basso lungo i gruppi (le colonne) della tavola periodica, più le dimensioni degli atomi aumenta e la tendenza del nucleo a tenersi vicino gli elettroni tende a indebolirsi. In estrema sintesi:
| PARTE SINISTRA DELLA TAVOLA PERIODICA | PARTE DESTRA DELLA TAVOLA PERIODICA |
| ELEMENTI MENO ELETTRONEGATIVI | ELEMENTI PIU’ ELETTRONIGATIVI |
| METALLI | NON METALLI |
| TENDONO A PERDERE ELETTRONI | TENDONO AD ACQUISIRE ELETTRONI |
A sinistra della tavola periodica troviamo i metalli, che in genere hanno meno elettroni nel loro livello energetico più esterno e hanno quindi la tendenza a perderli, assumendo un numero di ossidazione per lo più positivo,
A destra della tavola periodica troviamo i non metalli, che in genere hanno più elettroni nel loro livello energetico più esterno e hanno quindi la tendenza ad acquistarli, assumendo un numero di ossidazione per lo più negativo.
In cima a tutti gli elementi c’è l’idrogeno, che può comportarsi sia da metallo (se ha numero di ossidazione +1, in questo caso sarà nel composto l’elemento meno elettronegativo e si troverà per primo nella formula, come per gli acidi) che da non metallo (se ha numero di ossidazione -1, in questo caso sarà nel composto l’elemento più elettronegativo e si troverà alla fine della formula, come per gli idruri).
Nella nomenclatura tradizionale, in genere, all’inizio compare sempre la radice del nome dell’elemento più elettronegativo (il non metallo, con desinenza–uro) seguita dal nome dell’elemento meno elettronegativo (il metallo).
Ad esempio, nel cloruro di sodio (NaCl), l’elemento più elettronegativo è il Cloro, che tende ad attirare a se l’elettrone del Sodio e ad assumere carica -1.
Il numero di ossidazione è la carica che assume l’elemento quando si trova in un composto (positiva se ha perso elettroni e negativa se li ha acquistati).
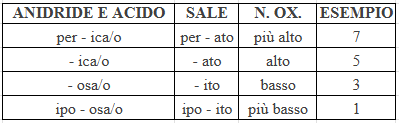
Ad esempio, nel cloruro di sodio (NaCl) il sodio assume numero di ossidazione +1 (l’unico possibile per questo elemento), e il cloro assume numero di ossidazione -1 (tra tutti i numeri di ossidazione possibili l’unico che sommato a +1 dà 0). Il numero di ossidazione influenza la nomenclatura come segue (un trucco da imparare per memorizzarla è pensare che Federico sia alto).
L’elenco dei possibili numeri di ossidazione si trova nella tavola periodica per ogni elemento.
I composti, tranne quelli ionici, hanno carica neutra e pertanto la somma dei numeri di ossidazione di tutti gli elementi deve essere pari a 0.
I composti ionici (ioni) possono invece avere carica positiva (cationi) o negativa (anioni). Nella formula il catione (il metallo) precede sempre l’anione (il non metallo).
Ad esempio, nel cloruro di sodio, il sodio è il catione Na+ e il cloro è l’anione Cl-.
Le sostanze le cui molecole sono costituite da due elementi (specie atomiche) sono dette composti binari, quelle costituite da tre, composti ternari… e così di seguito!
I nomi dei principali composti dipendono proprio dal fatto che prendano origine dai metalli o dai non metalli, o da una combinazione di entrambi, come è evidente in questo schema.
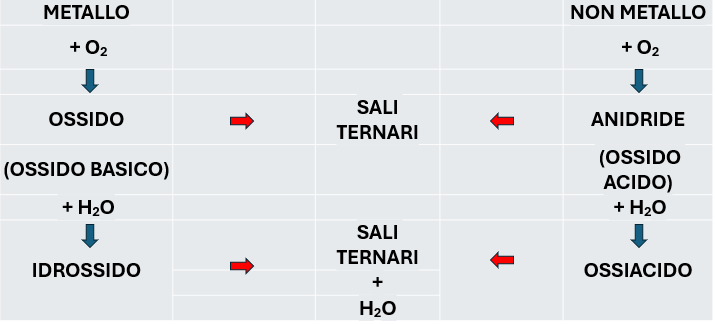
Tipi di composti binari
- molecole che contengono l’ossigeno (ossidi)
- molecole che non contengono ossigeno

1. OSSIDI (composti di un elemento con l’ossigeno
| Ossido (che contiene ossigeno) + di + elemento ossidato |
Esempi: MgO = Ossido di magnesio; CaO = Ossido di calcio.
La nomenclatura tradizionale suddivide queste due categorie in ulteriori sottoclassi, ovvero in ossidi basici se è un metallo a essere ossidato e anidridi se è un non metallo, che darà luogo a un acido.
- Ossidi basici (metallo + ossigeno)
Il nome degli ossidi rimane invariato rispetto alla terminologia IUPAC, ma prevede l’aggiunta di un prefisso al nome del metallo in questione se questo è in grado di formare due ossidi diversi. Si usa il suffisso -oso nel caso di stato di ossidazione minore, -ico nel caso di stato di ossidazione maggiore. - Esempi: Cu2O = Ossido rameoso; CuO = Ossido rameico
- Anidridi o ossidi acidi (non metallo + ossigeno)
Per le anidridi si utilizzano gli stessi prefissi degli ossidi basici, ma poiché alcuni elementi combinati con l’ossigeno possono avere più di due stati di ossidazione, si utilizza anche il prefisso ipo- nel caso dello stato di ossidazione minore di tutti, per- per il maggiore di tutti. Ad esempio per il cloro: - Esempi: Cl2O = Anidride ipoclorosa ; Cl2O3 = Anidride clorosa; Cl2O5 = Anidride clorica; Cl2O7 = Anidride perclorica
Fanno eccezione le anidridi del cromo e del manganese, elementi di transizione che, nonostante siano metalli, possono formare ossidi acidi con l’ossigeno, comportandosi come non metalli se si trovano negli stati di ossidazione più alti.
Esempi: CrO3 = Anidride cromica; MnO3 = Anidride manganica; Mn2O7 = Anidride permanganica
Per le molecole che non contengono l’ossigeno (idruri, idracidi e sali binari), si utilizza il suffisso -uro che segue il nome dell’elemento più elettronegativo, seguito dalla preposizione “di” e dal nome dell’altro elemento.
| elemento più elettronegativo – uro + di + elemento meno elettronegativo |
Esempi: HBr = Bromuro di idrogeno;
2. IDRURI (composti di idrogeno, che ha n.ox. -1, con metallo)
La forma del termine che segue idruro attiene alle regole già descritte.
Esempi: KH = Idruro di potassio; NH3 = Idruro di azoto (ammoniaca)
3. ACIDI BINARI (idracidi, composti di idrogeno, che n. ox = +1, con non metallo)
Sono composti formati dall’idrogeno e da un non-metallo più elettronegativo. Prendono il nome di acido seguito dal nome dell’altro elemento con il suffisso -idrico.
Esempi: HF = Acido fluoridrico; HCl = Acido cloridrico; H2S = Acido solfidrico
4. SALI BINARI (derivati dagli idracidi, composti da un metallo e un non metallo)
| elemento più elettronegativo – uro + di + elemento meno elettronegativo |
Queste molecole sono composte da un metallo e da un non metallo, al quale si attribuisce il suffisso -uro.
Esempi: NaCl = Cloruro di sodio; CuI = Ioduro rameoso
Composti ternari
Le molecole contengono tre diversi elementi e si suddividono in idrossidi, ossiacidi e sali ternari.
5. IDROSSIDI (composti contenenti lo ione OH⁻)
Sono costituiti da un metallo legato a un gruppo -OH, il quale conferisce caratteristiche basiche. Il loro nome tradizionale si ottiene mettendo il nome del metallo dopo il termine idrossido.
| IUPAC | Tradizionale | |
| NaOH | Idrossido di sodio | Idrossido di sodio |
| Al(OH)3 | Triidrossido di alluminio | Idrossido di alluminio |
| Fe(OH)2 | Diidrossido di ferro | Idrossido ferroso |
6. ACIDI OSSIGENATI (ossoacidi, contenenti ossigeno)
Sono composti vengono formati dall’aggiunta di acqua ad anidridi, e il loro nome, nella classificazione tradizionale, deriva proprio da quello dell’anidride.
- SO2 (Anidride solforosa) + H2O → H2SO3 = Acido solforoso
- SO3 (Anidride solforica) + H2O → H2SO4 = Acido solforico
Le stesse molecole, nella nomenclatura IUPAC, vengono chiamate rispettivamente acido triossosolforico e acido tetraossosolforico. In alcuni casi le molecole di acqua che possono reagire con l’anidride sono più di una, per questo motivo si aggiunge il prefisso meta- se una, piro- se due e orto- se tre.
P2O5 + H2O → 2HPO3 = Acido metafosforico
P2O5 + 2H2O → H4P2O7 = Acido pirofosforico
P2O5 + 3H2O → 2H3PO4 = Acido (orto)fosforico
7. SALI TERZIARI (o ossigenati, derivati dagli ossoacidi – metallo + non metallo + ossigeno)
Sostituendo gli atomi di idrogeno degli ossiacidi con metalli, si formano i sali ternari. Sono utilizzati nuovi suffissi in sostituzione ed in corrispondenza con quelli precedenti. In parentesi il nome IUPAC, in questo caso assai poco usati.
HNO2 = Acido nitroso → NaNO2 = Nitrito di sodio (diossonitrito di sodio)
HNO3 = Acido nitrico → NaNO3 = Nitrato di sodio (triossonitrato di sodio)
H3PO4 = Acido fosforico → K3PO4 = Fosfato di potassio (tetraossofosfato di tripotassio)
Andando ad aggiungere acqua oltre a metallo o non metallo e ossigeno avremo anche l’idrogeno come componente (composti ternari) e gli ossidi basici formeranno gli idrossidi, mentre le anidridi gli acidi.
I composti ternari (sali che contengono ossigeno) si trovano anche nella parte centrale della tabella.
In seguito, anche l’International Union of Pure and Applied Chemistry (IUPAC) ha stabilito nel 1919 linee guida dettagliate per la denominazione dei composti, basandosi soprattutto sulla composizione quantitativa in atomi delle molecole, secondo la formula bruta. I prefissi come “di-“, “tri-” e “tetra-” usati per descrivere le molecole indicano il numero di atomi presenti. Ad esempio, negli ossidi, composti con l’ossigeno, l’ossido di calcio (CaO) ha un atomo di ossigeno, il diossido di carbonio (CO2) ha due atomi di ossigeno.
Nella tabella sottostante le differenze principali tra la nomenclatura IUPAC e tradizionale con alcuni esempi :

Nella IUPAC per gli ossidi vengono utilizzati i prefissi numerici di origine greca (mono-, di-, tri-, tetra-, penta-, esa-, epta-) per identificare il numero (da 1 a 7) degli atomi di ogni elemento presente nella molecola.
Esempi: CO2 = Biossido di carbonio; N2O3 = Triossido di diazoto
La stessa cosa succede per gli idruri.
Esempi: Al2S3 = Trisolfuro di dialluminio; CaCl2 = Dicloruro di calcio
La nomenclatura di Stock è invece una variante semplificata della IUPAC, viene usata soprattutto per composti con metalli a valenza variabile e scrive il nome del composto seguito dal numero di ossidazione del metallo in numeri romani.
Il seguente file è un test per la nomenclatura tradizionale e IUPAC e verrà periodicamente aggiornato (come d’altronde anche questo articolo) in quanto potrebbero esserci errori, imprecisioni e incompletezze, ma ritengo che possa avere comunque la sua utilità.
Se pensate che possa essere utile allora potrete ringraziarmi comprando qualcosa su Amazon seguendo questo link.