La mole per contare grandi numeri di particelle.
Immagina di dover contare grandi quantità di oggetti molto piccoli, come chicchi di riso o granelli di sabbia. Invece di contarli uno per uno, è più pratico usare sacchetti con una quantità standard.
Ad esempio, potremmo dire che un sacchetto contiene sempre 1.000 chicchi di riso. Questo ci facilita la vita: invece di dire “ho 50.000 chicchi di riso”, possiamo dire “ho 50 sacchetti di riso”.

La mole funziona esattamente allo stesso modo, ma invece di contare i sassolini contiamo gli atomi e le molecole, che sono estremamente piccoli. Contarli singolarmente sarebbe impossibile, quindi la chimica ha stabilito la mole come unità di misura standard.
La parola “mole” in italiano indica una grande quantità di elementi: ad esempio si può dire “oggi ho una gran mole di compiti da fare”… e la Mole Antonelliana è un monumento enorme situato a Torino.

Una mole corrisponde quindi a tantissime entità, per la precisione 6,022 × 10²³ particelle (atomi, molecole o ioni). Questo numero è chiamato numero di Avogadro e viene indicato come NA.
Facciamo un esempio pratico.
Supponiamo di avere un sacchetto di mele, e sappiamo che ogni sacchetto contiene esattamente 10 mele. Se abbiamo 5 sacchetti, possiamo facilmente calcolare il numero totale di mele:
5 x 10 mele = 50 mele
Ora, immaginiamo che al posto delle mele ci siano molecole d’acqua (H₂O) e che al posto del numero 10 (quantità di mele in ogni sacchetto) ci sia il numero di Avogadro (quantità di particelle in ogni mole).

Se abbiamo 2 moli di acqua, significa che abbiamo:
2 x 6,022 x 10^23 molecole di H₂O = 12,044 x 10^23 molecole di H₂O
Se invece abbiamo mezza mole d’acqua abbiamo (tenendo conto del fatto che un mezzo equivale a 0,5):
0,5 x 6,022 x 10^23 molecole di H₂O = 3,011 x 10^23 molecole di H₂O

La situazione del numero di particelle non cambia se ad esempio consideriamo degli atomi di piombo, invece che delle molecole d’acqua.

Il legame con la massa
Come abbiamo visto, la mole è un “sacchetto” di particelle che ci aiuta a lavorare con quantità enormi in modo semplice ed efficace, ma il principale vantaggio della mole è che ci permette di collegare il numero di particelle alla massa.
Infatti, il peso in grammi di una mole di una qualsiasi sostanza, atomo o molecola che sia, corrisponde numericamente con il peso atomico o molecolare di quella sostanza.
I pesi atomici o molecolari si leggono o si ottengono dalla tavola peroodica.
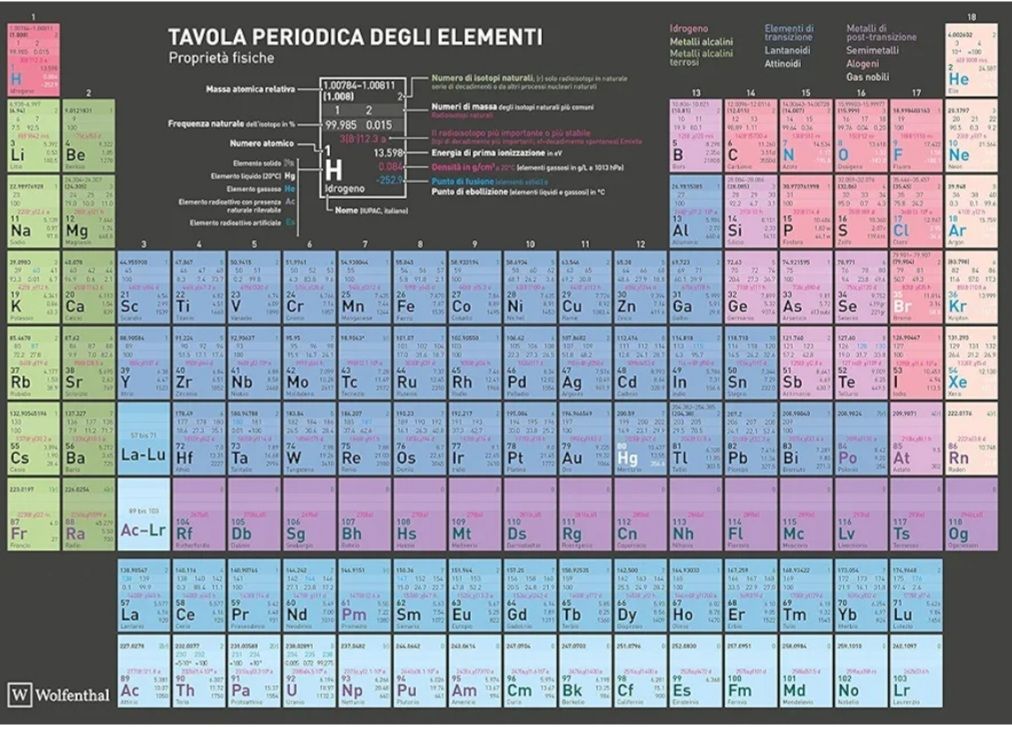
Ad esempio, sappiamo che una mole di acqua, che ha peso molecolare pari a 18 (come risultato della somma tra 16 per l’ossigeno + 2 per i due idrogeni) pesa 18 grammi. Quindi, se abbiamo 2 moli di acqua, sappiamo che pesano 36 grammi, senza dover contare ogni singola molecola!

Se invece dei sacchi di acqua avessimo dei sacchi di piombo, nonostante come abbiamo visto il numero di particelle sia lo stesso, il peso cambia molto.

Riepilogando, le seguenti sono le principali grandezze con cui abbiamo a che fare:

Le seguenti sono le principali formule, dirette e inverse.


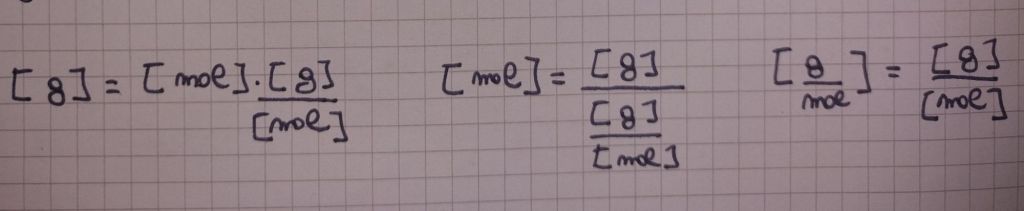
È fondamentale fare riferimento ai pesi indicati sulla tavola periodica per conoscere pesi atomoci e molecari delle particelle delle sostanze, e quindi la massa in grammi per mole delle stesse
